ال-سیترولین
.
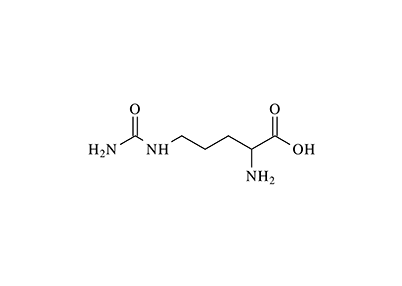
L-سیترولین یک آلفا–آمینواسید است که در تمام پستانداران شامل انسان، در گیاهان ودر حقیقت در مقادیر کم تقریباً در تمام ارگانیسمهای زنده وجود دارد. یکی از غنیترین منابع گیاهی L-سیترولین هندوانه (با نام علمی Citrullus vulgaris Schrader) است که این آمینواسید برای اولین بار از آن استخراج شد و نام آن نیز از نام علمی این میوه گرفته شده است.
L-سیترولین همچنین با مقادیر بالا در سایر اعضای خانواده گیاهان کدویی شامل خیار، کدو تنبل، خربزهی کوتور، خربزهی تلخ، کدو، کدوی قلیایی، کدوی رشتی، و طالبی وجود دارد.
این ماده همچنین با غلظتهای بالا در جوانههای کوچک و جوان درخت گردو یافت میشود و با مقادیر ناچیز و جزئی در دانه و شیرهی درخت White birch ژاپنی وجود دارد. L-سیترولین همچنین از هضم کازئین با واسطهی تریپسین نیز ایجاد میشود.
برای مشاهده متن مرجع و
رفرنس در کتاب PDR
for Nutritional Supplements اینجا
کلیک کنید.

نام برند
جی وی آیGVI
کشور تولید کننده
آمریکانام شرکت عرضه کننده
سی تو آراد پارستعداد در هر بسته
60 عدددسته بندی از لحاظ ترکیبات اصلی
ال-آرژنین,ال-سیترولین,ال-گلوتامین ,تیامین,روغن دانهی انگور فرنگی سیاه یا مویز سیاه ,نیاسین,ویتامین دی.شکل دارویی
کپسولقیمت
۰ ریال
نام برند
کارنKAREN
کشور تولید کننده
ایران/تولید داخلنام شرکت عرضه کننده
داروسازی کارنتعداد در هر بسته
300 گرمدسته بندی از لحاظ ترکیبات اصلی
ال-سیترولین,ال-گلوتامین ,بتا- آلانین,بتائین یا تری متیل گلایسین ,تورین,کراتین.شیرین کننده (سوکرالوز)، اسید سیتریک، طعم دهنده های مجاز خوراکیشکل دارویی
پودرقیمت
۰ ریالسوال خود را مطرح کنید. لطفا پیش از طرح سوال، پرسش و پاسخ های قبلی را ملاحظه فرمایید. ممکن است پرسش شما، قبلا پاسخ داده شده باشد
| نام علمی: | ال-سیترولین |
|---|---|
| نام علمی(لاتین): | L-Citrulline |
| دسته بندی: | پروتئین ها و اسیدهای آمینه |
| توضیحات علمی: |
L- سیترولین بعنوان یک آمینواسید غیر ضروری طبقهبندی میشود یعنی بدن
میتواند آن را در مقادیر کافی ...
L- سیترولین بعنوان یک آمینواسید غیر ضروری طبقهبندی میشود یعنی بدن میتواند آن را در مقادیر کافی جهت تأمین تمام نیازهای بیوشیمیایی و فیزیولوژیک خود بسازد. شرایطی وجود دارد که در آن بدن نمیتواند مقادیر کافی از این ماده را تولید کند. در این حالت L-سیترولین باید از طریق رژیم غذایی تأمین شود. یکی از این شرایط سندرم رودهی کوتاه است. روده محل اصلی تولید L-سیترولین در بدن میباشد. سندرم رودهی کوتاه یک ناهنجاری سوء جذب میباشد که در اثر برش و برداشتن قسمتی از رودهی باریک طی عمل جراحی ایجاد میشود. از این رو، مکان اصلی تولید L-سیترولین به مقدار زیادی کاهش یافته، در نتیجه سطوح پلاسمایی L-سیترولین کم شده و سطوح پلاسمایی L-آرژینین هم کاهش مییابد.(L-سیترولین پیش ساز اصلی L-آرژینین میباشد.)
در این شرایط L-سیترولین و L-آرژینین، هر دو، آمینواسید ضروری گشته و باید
از طریق رژیم غذایی تأمین شوند. از این رو بهتر است L-سیترولین و L-آرژینین
را بعنوان آمینواسیدهای نسبتاً ضروری یا ضروری تحت شرایط خاص در نظر
گرفت. اختلالات ژنتیکی ارثی خاصی درمتابولیسم اوره وجود دارد که در آنها مقادیر زیاد یا بسیار کم L-سیترولین تولید میشود. در هر دوی این حالات بیشتر ازاینکه اوره تولید شود، مقادیر اضافی از آمونیاک تولید میشود. این حالت را فقط یک ماهی استخوانی دفع کنندهی آمونیاک میتواند کنترل کند ولی برای انسان میتواند کشنده باشد. خوشبختانه، اختلالات ارثی در متابولیسم سیکل اوره نادر هستند. اولین مرحله در سیکل اوره واکنش بین آمونیاک و
بیکربنات میباشد که انرژی آن از طریق آدنوزین تری فسفات (ATP) تأمین
میشود و بوسیله آنزیم کربومیل فسفات سنتتاز (CPS) کاتالیز میشود تا
کربومیل فسفات تولید شود. دومین مرحلهی سیکل، واکنش بین کربومیل فسفات و
L-اورنیتین است که طی آن L-سیترولین تولید شده واین واکنش بوسیلهی آنزیم
اورنیتین ترنس کربامیلاز (OTC) کاتالیز میشود. کمبود هر یک از این دو
آنزیم منجر به کاهش سطح سرمی L-سیترولین شده و بوسیلهی L-سیترولین خوراکی
درمان میشود. با این
حال این اسید آمینه در برخی از پروتئینها یافت میشود که این حالت به
دلیل اصلاح آن پروتئینها بعد از ترجمه اتفاق میافتد. پروتئینهایی که به
این روش اصلاح شدهاند پروتئینهای سیترولینه نامیده میشوند. اخیرا، شواهدی کشف شده که نشان میدهند این
آمینواسید غیر پروتئینی نقش مهمی در تنظیم تولید پروتئینها دارد. |
| عملکرد: |
L-سیترولین فعالیت آنتی اکسیدانی داشته و ممکن است در کنترل فشار خون نیز نقش داشته باشد. L-سیترولین فعالیت آنتی اکسیدانی داشته و ممکن است در کنترل فشار خون نیز نقش داشته باشد. ادامه بستن متن |
| مکانیسم عمل: |
فعالیت آنتی اکسیدانی: L-سیترولین در برخی از گیاهان بعنوان متابولیت ثانویه عمل میکند. متابولیتهای ...
فعالیت آنتی اکسیدانی: L-سیترولین در برخی از گیاهان بعنوان متابولیت ثانویه عمل میکند. متابولیتهای ثانویه از گیاهان در برابر شرایط استرسی مختلف محافظت میکنند. این ماده از برگهای هندوانه، در برابر آسیب در شرایط خشکسالی محافظت میکند. در شرایط خشکی، تولید و تکثیر گونههای فعال اکسیژن شامل رادیکالهای هیدروکسیل افزایش یافته، که منجر به آسیبهای اکسیداتیو به سلولهای گیاهی شده و نوکلئیک اسیدها، پروتئینها، کربوهیدراتها و لیپیدهای آنها را تحت تأثیر قرار میدهد. سلولهای گیاهی چندین مکانیسم دفاعی آنتی اکسیدانی در برابر شرایط اکسیداتیو دارند که شامل مولکولهای کوچک آنتی اکسیدان و آنزیمهای آنتی اکسیدان میباشد.هر چند، تحت شرایط خشکی، استرس خشکی میتواند بر تمام این مکانیسمهای دفاعی غلبه کند. حتی هنداونهی معمولی که میخوریم نیز مقادیر قابل ملاحظهای L-سیترولین در پوست و میوهی خود میباشد. دیوید لیوینگستون مکتشف معتقد است که هندوانه از صحرای Kalahari منشأ گرفته است. البته غلظت L-سیترولین در هندوانههای صحرای Kalahari و برگهای آنها بسیار بیشتر از هندوانههایی است که ما میخوریم. مطالعات نشان دادهاند که L-سیترولین یک نابود کننده بسیار قوی رادیکالهای هیدروکسیل میباشد که از DNA و آنزیمهای متابولیک در برابر شرایط اکسیداتیو محافظت میکند. شناسایی مکانیسم دقیق اثر محافظت کنندهی L-سیترولین در برابر شرایط اکسیداتیو و واکنشهای شیمیایی مختلفی که بین L-سیترولین و رادیکالهای هیدروکسیل اتفاق میافتد نیاز به مطالعات بیشتری دارد. زمانی که فراهم زیستی NO در اندوتلیال کاهش مییابد، مانند استرسهای اکسیداتیو، عروقی خونی منقبض شده که منجر به افزایش فشار خون میشوند. مولکول سیگنال دهندهی NO با افزایش cGMP داخل سلولی (گوانوزین مونو فسفات حلقوی)، که منجر به فعال شدن پروتئین کیناز 1 وابسته بهcGmp (PKG1) میشود، تون عروقی را تنظیم میکند. این تحقیق 7 روز به طول انجامید و هدف آن تعیین مدلی برای انجام مطالعه بر روی اثر ضد فشار خونی L-سیترولین بود. نتایج این مطالعه نشان میدهد که L-سیترولین، به صورت وابسته به دوز، بیشتر از L-آرژینین، AUC (سطح زیر منحنی) و Cmax (حداکثر غلظت) L-آرژینین پلاسما را افزایش میدهد. حداکثر دوز L-سیترولین (3 گرم دو بار در روز) Cmin (حداقل غلظت) L-آرژینین پلاسما را افزایش داده، نسبت آرژنین-L /ADMA را بطور قابل توجهی زیاد میکند، که نشانگر کاهش اثر مهاری NOS میباشد- که سودمند است. علاوه بر این، cGMP ادراری و نیترات ادرار هر دو بطور قابل توجهی افزایش یافتند- که این مسئله نیز سودمند است. FMD با حالت پایهی بدون مصرف دارو هیچ تفاوتی نکرد- که چندان خوب نیست.ولی بررسی تمام اطلاعات و یافتههای FMD نشان داد که بین افزایش نسبت آرژنین-L /ADMA و بهبود FMD ارتباط وجود دارد. محققان این مطالعه به این نتیجه رسیدند که مکمل L-سیترولین غلظت پلاسمایی L-آرژینین را افزایش میدهد و بصورت وابسته به دوز ارسال سیگنال وابسته به NO را زیاد میکند. از این بررسی نتایجی بیشتر از این حاصل نشد. داوطلبان شرکت کننده در این مطالعه، سالم و دارای فشار خون نرمال بودند. فراهم زیستی پایین eNO عروق منجر به انقباض عروق و افزایش فشار خون میشود. آشکار شد که سطوح پایین NO در کلیهی SHR های ماده منجر به افزایش فشار خون در آنها میشود (مرحلهی prehypertension). در این بچه موشهای مؤنث، بیان ژن آرژینو سوکسینات سنتاز، که در تولید L-آرژینین کلیوی نقش دارد، و بیان ژن حامل-Y آمینواسید کاتیونیک کلیوی، که در باز جذب L-آرژینین نقش دارد، هر دو در SHRهای 2 روزه و 2 هفتگی در مقایسه با موشهای دارای فشار خون نرمال گروه کنترل کاهش یافته بود. علاوه بر این، SHRهای مؤنثی که 2 هفته سن داشته اند، NO بسیار کمتری در کلیه هایشان داشتهاند ولی در قلبشان اینگونه نبوده است. دادن مکمل L-سیترولین به موشهای مادر موجب افزایش میزان NOی کلیوی در بچه SHRهای مؤنث در 2 هفته شده و منجر به اصلاح دائمی فشار خون بالا در آنها شد. در بچه موشهای مؤنث SHR، افزایش فشار خون در مدت 20 هفته ایجاد شد. مکانیسم عمل اثرات ضد فشار خونی L-سیترولین آشکار نیست. یک فرضیه بیان میکند که پاسخ ضعیف به تغذیه در افراد مسن میتواند به علت باقی ماندن آمینو اسیدها در احشا باشد، یعنی تعداد کمی از آمینواسیدها به گردش خون سیستمیک میرسند. L-سیترولین، برخلاف L-آرژینین، توسط کبد برداشت و متابولیزه نمیشود و میتواند باعث بهبود بخشیدن به وضعیت تعادل نیتروژنی و وضعیت تغذیهای شود. در یک مطالعه روی موشهای پیر مبتلا به سوء تغذیه، دیده شد که مکمل L-سیترولین منجر به افزایش کلی در تولید پروتئین و افزایش میزان پروتئین در عضلات شد. یک رژیم غذایی استاندارد تأثیری روی تولید پروتئین یا محتوای پروتئین عضلات ندارد. مکانیسم دقیق این اثر آنابولیک احتمالی معلوم نیست. اخیراً، کشف شده است که L-سیترولین همچنین میتواند تولید پروتئین را درماهیچهها تحریک کند. مکانیسم عمل این تأثیر آشکار نیست ولی چندین تصور در مورد آن وجود دارد – شاید این تأثیر بعلت توانایی L-سیترولین در تولید L-آرژینین، یا بعلت تحریک ترشح انسولین و یا هورمون رشد و یا نقش L-سیترولین به عنوان یک حامل نیتروژن به داخل عضلات باشد. دو مورد اخیر ذکر شده تأثیرات غیرمستقیم L-سیترولین میباشد. اگرچه این اسید آمینه میتواند تأثیر مستقیم نیز در تحریک تولید پروتئین در عضلات داشته باشد.اخیراً چندین مطالعه احتمال تأثیر مستقیم |
| فارماکوکینتینک: |
ین بخش در مورد فارماکوکینتیک (PK) L-سیترولین با توضیح واکنشهای شیمیایی مختلفی که L-سیترولین در ...
ین بخش در مورد فارماکوکینتیک (PK) L-سیترولین با توضیح واکنشهای شیمیایی مختلفی که L-سیترولین در آنها بعنوان یک واکنش گر یا یک محصول شرکت دارد آغاز میشود. از این رو، L-سیترولین نمیتواند در همانجا (رودهی باریک) برای تولید L-آرژینین استفاده شود و به همان صورت به داخل گردش خون آزاد میشود. آنچه اهمیت دارد این است که L-سیترولین توسط کبد برداشت نمیشود و اساساً توسط کلیهها برداشت میشود. از آنجا که کلیه آرژینو سوکسینوسنتاز و آرژینوسوکسینولیاز فعال دارد، ولی سایر آنزیمهای سیکل اوره را ندارد، L-آرژینین آزاد میشود، و 75% از L-سیترولین تولید شده در رودهی باریک توسط کلیهها برداشت شده و در آنجا به L-آرژینین تبدیل میشود. سرعت تولید L-سیترولین در رودهی باریک عامل قطعی تنظیم کننده تولید کلیوی L-آرژینین میباشد. سیکل داخل ارگانی آرژینین–سیترولین–آرژینین به این دلیل است که L-آرژینین رژیم غذایی از تخریب بوسیلهی کبد حفاظت شود زیرا L-آرژینین در کبد توسط آرژیناز کاتابولیزه میشود. دلیل دیگراین امر این است که سرعت تولید اوره براساس میزان پروتئین دریافتی تنظیم شود زیرا L-آرژینین تنظیم کنندهی اصلی تولید اوره میباشد. (L-آرژینین فعال کنندهی N-استیل– گلوتامات است که آن نیز به نوبهی خود کربومیل فسفات سنتتاز را فعال میکند.) L-گلوتامین دومین تنظیم کنندهی اصلی سرعت تولید اوره میباشد؛ آمونیاک مشتق شده از متابولیسم L-گلوتامین، گلوتامیناز کبدی را افزایش میدهد. L-سیترولین همچنین میتواند هوموستاز پروتئین را حفظ کند، بویژه زمانیکه دریافت پروتئین کم میباشد. در شرایط دریافت کم پروتئین، بیان اورنیتین کربومیل ترنسفراز در کبد افزایش مییابد، که منجر به افزایش تولید L-سیترولین شده و از این رو تولید اوره در کبد را کاهش میدهد. مرحلهی اول در سیکل اوره تبدیل آمونیاک و دی اکسید کربن به کربومیل فسفات میباشد که توسط آنزیم کربومیل فسفات سنتتاز کاتالیز میشود. سپس کربومیل فسفات با L-اورنیتین واکنش میدهد تا L-سیترولین تولید شود که این واکنش بوسیلهی آنزیم اورنیتین ترنس کربومیلاز کاتالیز میشود. این دو واکنش در میتو کندری اتفاق میافتد؛و سه واکنش باقیمانده در سیتوزول. سپس L-سیترولین با آسپارتات واکنش میدهد تا آرژینو سوکسینات تولید شود و این مرحله توسط آنزیم آرژینو سوکسینات سنتاز کاتالیز میشود. سپس آرژینو سوکسینات به L-آرژینین و فومارات تبدیل میشود و این واکنش بوسیلهی آنزیم آرژینو سوکسیناز کاتالیز میشود. و در نهایت L-آرژینین به L-اورنیتین و اوره تبدیل میشود و کاتالیزور این واکنش آنزیم آرژیناز میباشد. این چرخه ادامه مییابد. محل انجام این واکنش در سلولهای توبول پروگزیمال کلیهها است. برخلاف L-آرژینین، L-سیترولین به طور کامل به کلیهها میرسد. L-آرژینین از L-سیترولین تولید میشود و خود L-سیترولین بوسیله توبولهای کلیوی باز جذب میشود. کمتر از 1% یک دوز خوراکی L-سیترولین به داخل ادرار دفع میشود. از این رو مشخص میشود که L-سیترولین نسبت به خود L-آرژینین فرم حامل بهتری برای L-آرژینین میباشد. همچنین نتیجه گرفته میشود که میتوان از L-سیترولین خوراکی برای افزایش فراهم زیستی L-سیترولین و L-آرژینین در گردش خون استفاده کرد بدون اینکه میزان دفع اوره افزایش یابد و از این رو بالانس نیتروژن در بدن انسانها برقرار میشود. |
| موارد مصرف: |
L-سیترولین، یک آمینواسید غیر پروتئینی پیش ساز L-آرژینین، میتواند در درمان/ پیشگیری از افزایش فشار ...
L-سیترولین، یک آمینواسید غیر پروتئینی پیش ساز L-آرژینین، میتواند در درمان/ پیشگیری از افزایش فشار خون، سندرم متابولیک و بیماری قلبی عروقی کمک کننده باشد. این ماده همچنین میتواند در حفظ/ بهبود متابولیسم پروتئین در برخی بیماریهای رودهای مانند سندرم رودهی کوتاه مفید باشد. از این دارو مدتها برای درمان برخی ناهنجاریهای ارثی سیکل اوره استفاده میشد. برخی این ماده را بعنوان یک روش ایمن استفاده از L-آرژینین و بعنوان آمینواسیدی که تحت شرایط خاص ضروری میشود، در نظر میگیرند و میتوان از آن بعنوان یک مکمل جایگزین در ناهنجاریهای مرتبط با کمبود L-آرژینین استفاده کرد. هیچگونه مدرک متقاعد کنندهای وجود ندارد که نشان دهد L-سیترولین میتواند عملکرد ورزشی را بهبود بخشیده و یا در درمان اختلال عملکردی نعوظ مفید باشد. هر چند که این ماده میتواند نقش مثبتی در متابولیسم پروتئین ماهیچهها داشته باشد. این مسئله که این ماده میتواند در برخی ناهنجاریهای خود ایمنی مانند روماتوئید آرتریت، پسوریازیس و مالتیپل اسکلروزیس مفید باشد در حد یک فرضیه باقی مانده است. |
| موارد منع مصرف : |
مکملهای L-سیترولین در افرادیکه به هر یک از اجزای تشکیل دهندهی مکملهای حاوی L-سیترولین حساسیت ...
مکملهای L-سیترولین در افرادیکه به هر یک از اجزای تشکیل دهندهی مکملهای حاوی L-سیترولین حساسیت دارند منع مصرف دارد. ادامه بستن متن |
| موارد احتیاط: |
استفاده از مکملهای L-سیترولین در هر شرایطی از سلامت باید توسط یک پزشک بررسی شود. بعلت عدم وجود ... استفاده از مکملهای L-سیترولین در هر شرایطی از سلامت باید توسط یک پزشک بررسی شود. بعلت عدم وجود مطالعات طولانی، زنان باردار و مادران شیرده نباید از مکملهای L-سیترولین استفاده کنند. هیچگونه نگرانی در مورد استفاده از مواد غذایی حاوی L-سیترولین مانند هندوانه وجود ندارد. ادامه بستن متن |
| عوارض جانبی: |
مصرف L-سیترولین تا 15 گرم در روز عموماً بخوبی تحمل میشود. اما دوزهای بسیار بالای این ماده علایم ...
مصرف L-سیترولین تا 15 گرم در روز عموماً بخوبی تحمل میشود. اما دوزهای بسیار بالای این ماده علایم گوارشی مانند اسهال ایجاد میکند. ادامه بستن متن |
| تداخلات: |
داروها تداخل دارویی شناخته شدهای وجود ندارد. مکملهای غذایی تداخل شناخته شدهای وجود ... داروها تداخل دارویی شناخته شدهای وجود ندارد. مکملهای غذایی تداخل شناخته شدهای وجود ندارد. غذاها تداخل شناخته شدهای وجود ندارد. مواد گیاهی تداخل شناخته شدهای وجود ندارد. ادامه بستن متن |
| نحوه و میزان مصرف: |
مکملهای L-سیترولین وجود دارند. دوز معمول این ماده 3 گرم در روز میباشد. دوز بهینهی آن مشخص نیست. ...
مکملهای L-سیترولین وجود دارند. دوز معمول این ماده 3 گرم در روز میباشد. دوز بهینهی آن مشخص نیست. هندوانه یک منبع غنی از L-سیترولین میباشد. غلظت L-سیترولین در هندوانههای دانه دار از 5/0 تا 6/3 میلیگرم به ازای هر گرم از میوهی تازه و بطور متوسط 8/1 میلیگرم به ازای هر گرم از میوه تازه میباشد. غلظت L-سیترولین در هندوانههای بدون دانه از 7/0 تا 5/3 میلیگرم به ازای هر گرم از میوهی تازه و بطور متوسط 4/2 میلیگرم به ازای هر گرم از میوهی تازه میباشد. ادامه بستن متن |

نام برند
جی وی آیGVI
کشور تولید کننده
آمریکانام شرکت عرضه کننده
سی تو آراد پارستعداد در هر بسته
60 عدددسته بندی از لحاظ ترکیبات اصلی
ال-آرژنین,ال-سیترولین,ال-گلوتامین ,تیامین,روغن دانهی انگور فرنگی سیاه یا مویز سیاه ,نیاسین,ویتامین دی.شکل دارویی
کپسولقیمت
۰ ریال
نام برند
کارنKAREN
